化学原料药受理审查指南(试行)(2023)
化学原料药受理审查指南(试行)
(2023)
| 发文机关 | 国家药品监督管理局 药品审评中心 |
|---|---|
| 发文字号 | 2023年第38号 |
| 发布日期 | 2023年6月30日 |
| 施行日期 | 2023年6月30日 |
| 法律效力位阶 | 规范性文件 |
| 原文链接 | https://www.cde.org.cn/main/news/viewInfoCommon/46bc16e98abddf4095de30e659fc4385 |
| 法规发布公告 | 国家药监局药审中心关于发布《化学原料药受理审查指南(试行)》的通告(2023年第38号) |
| 现状: 施行中 | |
本指南基于现行法律法规要求制定,对于指南中未涵盖或未明确的受理事宜,登记人可与受理部门进行沟通。后续将根据相关法律法规等文件要求适时更新。
一、适用范围
化学原料药上市申请登记。
二、受理部门
国家药品监督管理局药品审评中心。
三、资料基本要求
按照《药品注册管理办法》、《国家药监局关于进一步完善药品关联审评审批和监管工作有关事宜的公告》、《化学药品注册分类及申报资料要求》的规定,提供符合要求的登记资料。登记资料应根据现行版《M4:人用药物注册申请通用技术文档(CTD)》(以下简称CTD)格式整理,目录及项目编号不能改变。登记资料文件夹目录按要求进行编制。
(一)登记表的整理
《原料药登记表》,《小型微型企业收费优惠申请表》(如适用)填写应当准确、完整、规范,不得手写或涂改,并应符合填表说明的要求。登记表数据核对码应与在线提交的登记表核对码一致。
(二)登记资料的整理
登记人应按照《国家药监局关于实施药品注册申请电子申报的公告》(2022年第110号)、《关于药品注册申请电子申报有关要求的通知》的要求准备电子申报资料,登记人需对申报资料中的所有PDF文件使用登记人或注册代理机构的电子签章。
四、形式审查要点
(一) 光盘及文件格式审查要点
光盘外观清洁无划痕并保持完整,光盘表面不应粘贴标签。光盘内容可顺利读取。光盘硬盒及档案袋均按要求加贴封面。光盘中登记资料格式,文件夹及文件名符合《关于药品注册申请电子申报有关要求的通知》的要求。
(二) 登记事项审查要占
1.登记人应当按照关联审评审批制度要求,在化学原料药、辅料及直接接触药品的包装材料和容器登记平台登记化学原料药(不含制剂中间体)。
2同一企业在同一生产场地生产的同一化学原料药,生产工艺和质量标准相同的,应按照同一登记号登记。对同一原料药存在不同生产工艺的,原则上,应按照不同登记号进行登记,并提交相应登记资料。同一企业以不同登记号登记相同名称化学原料药的应在登记表特别声明事项中说明理由及原登记号的情况。
3.化学原料药审评期间,发生可能影响药品安全性、有效性和质量可控性的重大变更的,登记人应当撤回原登记,补充研究后重新申报。登记人名称变更、注册地址名称变更等不涉及技术审评内容的,应当及时书面告知药品审评中心并提交相关证明性资料。
4.境外生产化学原料药登记人应委托中国境内的企业法人进行登记,境内生产化学原料药的登记人应为原料药生产企业。
(三)登记表审查要点
按照《原料药登记表填表说明》的要求规范填写登记表,填报信息应与登记资料中相应内容保持一致。
1.其他特别申明事项:如已向中检院或省、自治区、直辖市药品监督管理部门申请前置注册检验的,应予以说明并提交送检凭证。如符合小微企业免收注册费用的,登记人应予以说明,并提交《小型微型企业收费优惠申请表》等电子资料。如属于关联审评审批情形的,登记人应填写被关联制剂品种名称及其申请人信息。
2.上市申请登记时如属于仿制境内已上市药品所用的化学原料药可选择单独审评程序,并同时填写境内已上市制剂信息(至少填写一个制剂)。
3.产品中文名称:仿制化学原料药应当使用国家药品标准或者药品注册标准收载的药品通用名称。未列入国家药品标准或者药品注册标准的,登记人在提出上市申请登记时,应当提交通用名称证明文件,或同时提出通用名称核准申请(需单独准备光盘)。
4.包装:如有多个包装材质要分别填写,中间用句号分开。包装规格:原则上应使用具体明确的数字单位进行表示,每一份登记表可填写多个包装规格。
5.拟用制剂给药途径应按照药品实际情况准确填写,可多选。
6.有效期:以月为单位填写。如有多个包装材质,有效期如有不同则要分别对应填写。
7.是否涉及特殊管理药品或成分:属于麻醉药品、精神药品、医疗用毒性药品、放射性药品的,应填写。
8.包材来源应填写包材名称、登记号(如有)和生产商
9.化学原料药登记人、生产企业、注册代理机构企业名称、地址等信息应与证明文件中相应内容保持一致,并指定其中一个申请机构负责缴纳注册费用。已经填入的各机构均应当由其法定代表人或接受其授权者(另需提供签字授权书原件,授权书应加盖公章(如有))在此签名、加盖机构公章(须与其机构名称完全一致)。
(四)登记资料审查要占
关于取消证明事项的公告中规定的“改为内部核查"的证明事项,按公告要求执行。
1.证明性文件
1.1药包材证
1.1.1药包材合法来源证明文件,包括供货协议、发票等(适用于原料药未选用已登记包材情形)。
1.1.2药包材授权使用书(适用于原料药选用已登记包材情形)。如为供应商出具,需有药包材企业授权,并附授权信。
1.2专利信息及证明文件
登记原料药的化合物、工艺、用途等专利情况及其权属状态说明,以及对他人的专利不构成侵权的声明。应由登记人出具,并承诺对可能的侵权后果承担全部责任。
1.3特殊药品研制立项批准文件(如适用)麻醉药品和精神药品需提供研制立项批复文件。
1.4境内生产化学原料药证明文件
生产企业的营业执照和已取得相应范围的《药品生产许可证》及变更记录页。
1.5境外生产化学原料药证明文件
1.5.1境外药品管理机构出具的允许该化学原料药上市销售证明文件、公证认证文书及中文译文,化学原料药生产企业符合药品生产质量管理规范的证明文件、公证认证文书及中文译文。也可提供欧洲药典适用性证明文件(CEP, Certificate of Suitability to the Monographs of the European Pharmacopeia)与附件;或者该化学原料药主控系统文件(DMF, Drug Master File)的文件号以及采用该化学原料药的制剂已在国外获准上市的证及该原料药生产企业符合药品生产质量管理规范的证明文件(若因该原料药仅供企业集团内部使用等原因,而无法提供DMF号,可由境外登记人出具相应情况说明)。
对于生产国家或地区按食品管理的化学原料药,应提供该国家或地区药品管理机构出具的该生产企业符合药品生产质量管理规范的证明文件,或有关机构出具的该生产企业符合IS09000质量管理体系的证明文件,和该国家或者地区有关管理机构允许该品种上市销售的证明文件。
境外生产的1类、2.1类化学药品所用原料药参照相应制剂要求提交相关证明文件。
登记人应承诺:审评审批期间,相关证明性文件载明的境外监管状态信息,如生产上市情况、GMP合规情况等内容发生变化的,及时如实告知监管部门。
1.5.2境外登记人指定中国境内的企业法人办理相关化学原料药登记事项的,应当提供委托文书、公证文书及其中文译文,以及注册代理机构的营业执
1.6小微企业证明文件(如适用)
企业的工商营业执照副本复印件;上一年度企业所得税纳税申报表(须经税务部门盖章确认)或上一年度有效统计表(统计部门出具)原件。
2.其他登记资料
上市申请登记时应按要求提交工艺验证方案和报告。仿制化学原料药至少需要包括三个注册批样品6个月稳定性试验数据。
(五)其他提示
1.模块一说明函内容应同时提交不适用的文档清单及说明(如适用)。
2.境外生产的化学原料药所提交的境外药品管理机构出具的证明文件(包括允许化学原料药上市销售证明文件、符合药品生产质量管理规范证明文件),为符合世界卫生组织推荐的统一格式的,可不经所在国公证机构公证及驻所在国中国使领馆认证。
3.审评审批过程中,如相关证明性文件超过有效期,申请人应当及时通过公文向药审中心递交更新的证明性文件。
4.光盘资料中应按照《关于药品注册申请电子申报有关要求的通知》的要求提供承诺书。
5.登记人应当在三十日内完成补正资料,登记人无正当理由逾期不予补正的,视为放弃申请,并将登记资料光盘按程序销毁。
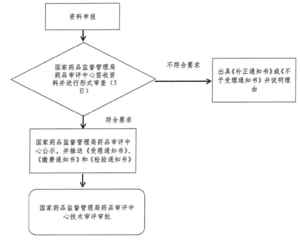
五、受理审查决定
(一)受理
1.受理通知书:符合形式审查要求的,出具《受理通知书》(加盖局行政许可受理专用章)。
2.缴费通知书:需要缴费。
(二)补正
登记资料不齐全或者不符合法定形式的,应一次告知登记人需要补正的全部内容,出具《补正通知书》。
(三)不予受理
不符合要求的,出具《不予受理通知书》,并说明理由。
(四)受理流程图
六、其他
他未尽事宜请参照《药品注册管理办法》、《化学药品注册分类及申报资料要求》等现行的规定、技术指导原则有关文件执行。
七、附件
1.参考目录
附1:参考目录
1.《药品注册管理办法》(总局令27号)
2.《化学药品注册分类及申报资料要求》
3.《关于调整原料药药用辅料和药包材审评审批事项的公告》(2017年第146号)
4.《关于调整化学仿制药长期稳定性研究申报资料要求的通告》(2018年第82号)
5.《关于进一步完善药品关联审评审批和监管工作有关事宜的公告》(2019年第56号)
6.《关于取消36项证明事项的公告》(2019年第34号)
7.《关于取消16项证明事项的公告(第二批)》(2019年第55号)
8.《关于取消68项证明事项的公告(第三批)》(2019年第102号)
9.《关于贯彻实施《中华人民共和国药品管理法》有关事项的公告》(2019年第103号)
10.《关于发布《M4模块一行政文件和药品信息》的通告》(2020年第6号)
11.《国家药监局关于实施药品注册申请电子申报的公告》(2022年第110号)
12.《关于药品注册申请电子申报有关要求的通知》
13.《关于发布<药品注册申请审评期间变更工作程序(试行)>的通知》
