国家药监局关于实施药品电子通用技术文档申报的公告(2021年第119号)
国家药监局关于实施药品电子通用技术文档申报的公告
为落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号)和《国务院办公厅关于全面加强药品监管能力建设的实施意见》(国办发〔2021〕16号)文件精神,实现药品注册申请的电子申报,提升“互联网+药品监管”应用服务水平,国家药品监督管理局全面开展和推进了药品电子通用技术文档(eCTD)申报相关工作。现将实施eCTD申报有关事项公告如下:
一、 实施时间和实施范围
自2021年12月29日起,化学药品注册分类1类、5.1类,以及治疗用生物制品1类和预防用生物制品1类的上市许可申请,可按照eCTD进行申报。
二、 eCTD申报资料格式和实施要求
申请人应按照eCTD技术文件(附件1—4)要求准备和提交eCTD申报资料光盘,并在eCTD注册申请新报资料受理后5个工作日内,提交纸质资料。申请人如未按照规定时间提交纸质资料,按终止药品注册程序处理。同时,申请人应承诺所提交的电子资料与纸质资料内容完全一致,如因资料一致性产生的任何问题由申请人自行承担。
三、 其他事项和要求
为确保eCTD稳步推进,减少对申报工作的影响,对于上述注册申请,申请人仍可选择现有注册方式进行注册申报。
采用eCTD申报的注册申请,申请人无需再单独提交核查检验用申报资料光盘和临床试验数据库光盘。
相关技术指导原则可在国家局药品监督管理局药品审评中心网站查询。国家药品监督管理局药品审评中心做好本公告实施过程中的相关技术指导工作。
特此公告。
附件:
1.eCTD技术规范V1.0
2.eCTD验证标准V1.0
3.eCTD实施指南V1.0
4.eCTD技术规范V1.0附件包
国家药监局
2021年9月29日
| 发文机关 | 国家药品监督管理局 |
|---|---|
| 现状: | |
附件1:eCTD技术规范
引言
电子通用技术文档(eCTD)模型结构
下图是针对一个 eCTD 新药申请首次申请首次提交的全套申报资料输出文件夹的结构示例,包括模块一至模块五的内容文件,2 个骨架文件(XML 文件),1 个存放 DTD 相关文件的 util 文件夹及 1 个存放 MD5 值的文本文件。

本文档结构说明
本文档主要包含以下内容:
第一章,介绍本文档的目的、范围和应用以及相关配套文件。
第二章,介绍一套 eCTD 申报资料所需要包含的信息及其层级结构。
第三章,对在《ICH eCTD 技术规范 V3.2.2》等相关规范中未作要求,或明确指出由实施地区监管机构自行决定的区域性管理信息进行说明。
第四章,针对区域性管理信息中的模块一部分,对其总体架构进行具体说明。
第五章,介绍本文档的参考文件。
第六章,介绍本文档相关术语。
1. 介绍
1.1 目的
eCTD 是用于药品注册申报和审评的电子注册文件。通过可扩展标记语言(Extensible Markup Language,XML)将符合通用技术文档(CTD)规范的药品申报资料以电子化形式进行组织、传输和呈现。
本文档为 eCTD 技术规范,用以指导 eCTD 软件公司开发符合要求的 eCTD 出版软件,及申请人制作符合要求的 eCTD 申报资料。
在本文档中将使用 CN 作为中国的区域代码。
1.2 范围和应用
本文档对 eCTD 模块一行政文件和药品信息,以及其他区域性信息进行了说明。
申请人准备eCTD申报资料,除本文档外,还应参考《ICH eCTD 技术规范 V3.2.2》等相关规范。
1.3 配套文件
eCTD 技术规范还包括以下配套文件:
1. ICH 文档类型定义(DTD)文件和区域 Schema 文件 DTD 和 Schema 都是用于对 XML 文档结构进行规范并验证其有效性的定义和描述文件。
DTD 文件指 ICH 发布的“ich-ectd-3-2.dtd”和“ich-stfv2-2.dtd”文件,用于对 eCTD 骨架文件、研究标签文件(STF)的有效性进行技术验证。模块二至模块五的骨架文件及研究标签文件中将引用上述 DTD 文件,请参考附件 2-1:ICH DTD 文件和附件 2-2:ICH STF DTD 文件。
区域 Schema 文件指“cn-regional-1-0.xsd”文件,用于定义 eCTD 信封信息和模块一的标题,对区域性信息进行技术验证以确保申报资料相关信息的准确性, “xlink.xsd”和“xml.xsd”文件作为区域 Schema 文件的引用文件,用于定义 XML 文件的基本结构,请参考附件1-1:区域 Schema 文件、附件 3-1:w3c 标准 xlink 结构定义文件、附件 3-2:w3c 标准 xml 命名规范定义文件。
2. 受控词汇文件
一套 XML 格式的代码定义文件,用以实现多语言显示/处理。代码定义文件主要包含内容有:eCTD 的有效标题列表、提交的申请中使用的代码类型、代码名称、中英文显示值、以及包括有效日期在内的代码版本控制信息,请参考附件 1-2:受控词汇文件包。
3. eCTD 验证标准
验证标准提供了验证项目描述、验证项目详细说明、严重程度(错误、警告、提示信息),用于对申报资料进行验证,指导申请人如何纠正错误,制作出符合 eCTD 标准的申报资料。
4. 样式表格文件
样式表格文件包括 ICH 发布的“ectd-2-0.xsl”文件、“ich-stf-stylesheet-2-2a.xsl” 或 “ich-stf-stylesheet-2-3.xsl”文件,以及模块一的样式表格文件“cn-regional-1-0.xsl”,分别用于规定模块二至模块五的骨架文件、申报资料中的 STF 文件和模块一的骨架文件的展示样式,请参考附件 2-3:ICH 样式文件、附件 2-4:ICH STF 样式文件 2-2a、附件 2-5:ICH STF 样式文件 2-3、附件 1-3:区域样式文件。
5. STF 相关属性和标签有效值定义文件
ICH 发布的“valid-values.xml(version 5)”文件,用于定义 STF 文件中使用到的属性值和标签值,请参考附件 2-6:STF 标签值文件。
6. CTD 模块一文件组织结构
用于定义模块一文件夹和文件的编号、标题名称、元素名称、相对路径等信息,请参考附件 1-4:CTD 模块一文件组织结构。
2. eCTD 申报资料结构
eCTD 申报资料由申请、注册行为和序列三个层级来定义。每个层级都包含一系列相关信息,即申请信息、注册行为信息和序列信息。
关于申请、注册行为、序列输出文件夹的层级示例如下图 1 所示。
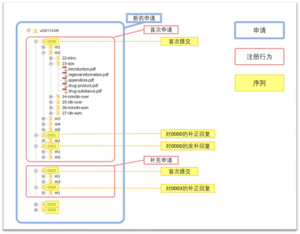
2.1 申请信息
申请是指为了一个特殊的监管目的(如临床试验申请)来整理和提交的申报资料的集合。一个药品在临床试验和新药申请,或临床试验和仿制药申请两个阶段,对应两套独立的申报资料集合,即两个申请。
每个申请信息包含申请编号、申请类型、产品类型、原始编号信息。
2.1.1 申请编号
申请编号是一个申请在其全生命周期内的唯一识别编号,由监管机构分配给申请人。
在首次提交临床试验申请、新药申请或仿制药申请的 eCTD 序列时,申请人应从监管机构获取相应的申请编号。
申请编号编码规则如下所示:
字母(x=新药申请;y=仿制药申请;l=临床试验申请)+年份(4 位数字)+5 位流水号。
例如:x202112345。
2.1.2 申请类型
申请类型是一组定义的类型,用以描述申请的目的。有关申请类型的详细信息请参考附件 1-2 受控词汇文件中 cvapplication-type.xml 文件的最新版本。
2.1.3 产品类型
产品类型是一组定义的类型,用以描述产品分类信息。有关产品类型的详细信息请参考附件 1-2 受控词汇文件中 cv-product-type.xml 文件的最新版本。
2.1.4 原始编号
原始编号是对一个进入注册审批程序的药品所给予的基本的和永久的资料代号,是用于标识申请人、活性成分和剂型的唯一识别码,由监管机构分配。
原始编号编码规则为年份(4 位数字)+6 位流水号,例如:2021123456。
2.2 注册行为信息
注册行为是指针对某一特定注册目的从首次提交到获得批准的所有序列的申报资料集合,可以包含一个序列或多个序列。同一个注册行为中的多个序列可以是连续的序列,也可以是不连续的序列。
每个注册行为信息包括注册行为类型信息和相关序列信息。
2.2.1 注册行为类型
注册行为类型是一组定义的类型,用于描述注册行为的目的。有关注册行为类型的详细信息请参考附件 1-2 受控词汇文件中 cv-regulatory-activity-type.xml 文件的最新版本。
2.2.2 相关序列
相关序列用于将一个申请中的序列按照注册行为进行分组。一个注册行为中首次提交的序列被称为该注册行为中提交的所有序列的相关序列。
相关序列应用的具体示例如下表1和下表2所示:
表1:临床试验申请的相关序列示例
表2:新药申请的相关序列示例
2.3 序列信息
序列是指在某一注册行为中单次提交的申报资料的集合。
每个序列信息包括序列号、序列类型、序列描述和序列联系人信息。
2.3.1 序列号
序列号是申请中唯一的 4 位数字的字符串,是用于区分同一申请中不同提交序列的唯一标识。
申请人应从 0000 开始提交,每次提交时须将序列号加1,并按先后次序提交,不得跳号提交。
2.3.2 序列类型
序列类型是一组定义的类型,用于描述序列的目的。有关序列类型的详细信息请参考附件 1-2 受控词汇文件中 cvsequence-type.xml 文件的最新版本。
2.3.3 序列描述
序列描述是对序列提交目的的简要描述,用于区分相似类型的序列。序列描述长度应在 120 个中文字符以内。
以下列出了一些序列描述的示例:
1. 适应症为 xx 的新药上市申请
2. 对序列 xx 的发补回复
3. 药品生产商的变更,从 xx 改为 yy
4. 增加新的原料药生产商,xx
5. 增加新适应症 xx
6. xx(方案编号)方案修正
申请人填写的序列描述不得替代对监管机构问题的回复、说明函,或用于向监管机构提问等。
2.3.4 序列联系人信息
序列联系人信息是对该序列的申报资料负责的联系人信息。申请人需要提供的信息包括联系人姓名、电话及邮箱地址。
2.4 申请、注册行为和序列的关系
申请人应按照现行注册程序,并根据申报资料的实际情况选择对应的申请类型、注册行为类型和序列类型。有关申请类型、注册行为类型、序列类型对应关系的详细信息请参考附件 1-2 受控词汇文件中 depend-apt-rat-sqt.xml 文件的最新版本。下表 3 举例说明了申请类型、注册行为类型、序列类型的一些实际应用:
表3:申请、注册行为和序列的关系
3. 区域性管理信息
本章节规定了 eCTD 的区域性管理信息。
3.1 模块一的行政文件和药品信息
模块一的总体构架请参见本文档第四章节。
3.2 3.2.R 章节的使用
区域性药学信息应位于 3.2.R 章节。
对于生物制品,3.2.R 章节需进行粒度细分以符合注册申报资料提交要求。该细分的粒度应使用扩展节点和子文件夹来构建。
扩展节点的标题命名规则如下表 4 所示:
表4:3.2.R 章节扩展节点标题命名规则
扩展节点在骨架文件中的内容如下图 2 所示:

其他 3.2.R 章节的技术规范参照《ICH eCTD 技术规范V3.2.2》执行。
3.3 文件和文件夹
3.3.1 内容文件的格式
对于 eCTD 申报资料,适用的文件格式有以下五种:
1. 便携文件格式(PDF)- .pdf 文件扩展名
例如:审评内容文件
2. 可扩展标记语言 (XML)- .xml 文件扩展名
例如:eCTD 骨架文件
3. SAS XPORT 传输文件 - .xpt 文件扩展名
例如:临床试验数据文件
4. 文本文件(TXT)- .txt 文件扩展名
例如:程序代码文件
5. 可扩展样式表语言文件(XSL)- .xsl 文件扩展名
例如:XML 文档的可视化格式文件
3.3.2 文件和文件夹命名规则
eCTD 申报资料文件及文件夹命名仅允许使用下列字符:小写字母“a”至“z”、数字“0”至“9”、中划线“-”和下划线1 “_”。 对于申报资料中的任一文件,由序列文件夹开始的所有文件夹和文件名(含扩展名)路径长度不应超过 180 个字符,单一文件夹或文件名称(含扩展名)长度不应超过 64 个字符。
1《ICH eCTD技术规范V3.2.2》中规定的文件命名要求不允许使用下划线,但在临床数据集提交时,SAS XPORT文件的命名可能会使用下划线。考虑到在其他国家监管机构按照eCTD格式递交的临床数据集文件命名也允许使用下划线,并且在《ICH eCTD技术规范V4.0》中也将允许文件命名使用下划线,因此本技术规范允许在对文件和文件夹的命名中使用下划线。
其他命名规则参见下表 5。
所有目录结构都必须在 XML 骨架文件中被引用,以有效地导航到指定位置。
表5:文件与文件夹命名规则示例
3.3.3 关于空缺章节的处理
申请人提交的序列文件夹中不允许存在空文件夹,即没有文件或子文件夹的文件夹。
申请人提交的序列中不允许存在占位文档,即不允许存在没有任何实际内容的文档。对于申请中不适用的章节,申请人应在模块一的说明函中进行说明,而无需在 eCTD 编制过程中单独递交“不适用”文档作为占位文档。
3.3.4 文件的重复使用
文件复用包括两种情况,即引用同一序列中的文件和引用同一申请中前序序列中的文件。申请人如需要在同一个申请中提交相同的文件,无需重复提交实体文件,只需在骨架文件中对应章节生成叶元素并引用相应实体文件的位置。
不支持跨申请引用,即不允许引用另一个申请中提交的文件。
更多关于文件复用的说明请参考《ICH eCTD 技术规范 V3.2.2》附录 6 中的文件重复使用章节。
3.4 PDF 电子提交标准
PDF 是 eCTD 申报资料的主要文件格式。《ICH eCTD 文件格式规范 V1.2》(参见本文档第五章节)为创建用于 eCTD 提交的 PDF 文件提出了建议,主要包括以下方面:限制、版本、文件大小、字体、字体大小、字体颜色、页面方向、页面大小和页边距、页眉和页脚、电子文件来源、创建 PDF 文档和图像的建议、压缩图像减少文件大小、图像颜色匹配、ICC 配置文件、文档导航(超文本链接、书签和目录)、页码、初始视图设置、优化、安全、使用 Acrobat 插件。
除参考上述规范外,申请人还应遵循以下要求:
1. 如果提交的单个申报资料文件(除外文参考资料、参考文献和申请表之外)内容超过五页,需要提供对应的目录(正文目录、表格目录、图表目录)和书签来辅助导航。
2. 在不能使用目录和书签进行文档导航的情况下可使用超文本链接来帮助定位。例如,位于不同页的相关章节、文献、附件、表格及图表可以创建超文本链接进行导航。申请人创建的跨文档超文本链接至少应包括:由模块一的上市后变更/研究等项目到模块二至模块五中的具体内容之间的超文本链接、由模块二的概述和总结文件到模块三至模块五的详细信息之间的超文本链接、由临床研究报告到对应附件(如图表)之间的超文本链接、PDF 格式的临床数据集数据说明文件至相应 xpt 文件的超文本链接等。为避免超文本链接失效或定位错误,申请人不应在申报资料中创建跨申请超文本链接。
3. 针对中文申报资料的要求:
(1) 字体:宋体
(2) 字号
1) 正文:不小于小四号字
2) 表格:不小于五号字
3) 目录:小四号字
4) 脚注:五号字
(3) 字体颜色
1) 叙述性文字:黑色
2) 超文本链接:建议使用蓝色文字或黑色文字带蓝色框表示
3.5 外文参考资料的要求
申请人提交的全部申报资料应当使用中文并附原文,其他文种的资料可附后作为参考。中文译文应当与原文内容一致。
在eCTD 骨架文件中,外文参考资料应放置在对应的中文申报资料同级目录结构中,即同一目录元素下的不同叶元素中。中文申报资料在前并使用中文叶标题进行标识,外文参考资料在后并使用外文叶标题进行标识,申请人可使用“xml:lang”属性对中文申报资料及其外文参考资料进行区分。
中外文申报资料在骨架文件中的内容示例如下图3所示:

3.5.1 语言属性的设置
在 eCTD 骨架文件中,每个叶元素都代表一个对应的文件。叶元素中包含了一个可选属性“xml:lang”,该属性标识了当前叶元素对应的文件将被视为中文申报资料或外文参考资料。设置该属性值时应遵循 ISO639-1 标准。在以下情况时,叶元素对应文件将被识别为中文申报资料:
1. 语言属性设置为中文(zh),如下图 4 所示:

2. 语言属性设置为空,如下图 5 所示:

3. 未设置语言属性,如下图 6 所示:

在以下情况时,叶元素对应文件将被识别为外文参考资料:
1. 语言属性设置为外文,如下图 7 所示:

2. 语言属性设置为无效的值,如下图 8 所示:

3.5.2 语言属性的生命周期管理
使用 eCTD 生命周期操作“替换”,将前序序列中提交的文件替换为新文件时,被替换的文件和新文件应具有相同的语言属性。即中文申报资料只能被另一份中文申报资料所替换,而外文参考资料只能被另一份外文参考资料所替换。
3.6 eCTD 骨架属性和元数据
eCTD 骨架属性指申报资料模块一至模块五章节的相关属性的集合,包括了本文档 4.3 章节中定义的信封元素属性以及《ICH eCTD 技术规范 V3.2.2》中定义的模块二至模块五的属性。
元数据是申请人为模块一至模块五章节相关属性设定的值的集合。
ICH eCTD DTD 中定义了模块二至模块五部分章节的选填属性和必填属性(例如 2.3.S 及 3.2.S 中的活性成分及生产商为必填属性,2.3.P 及 3.2.P 中的产品名称、剂型、生产商为选填属性)。这些属性是为了对该特定章节的内容进行简单有用的描述,以便于对内容进行区分和分组。
申请人对 ICH 元数据进行更新时,必须同时提交该属性对应的全部申报资料的内容变更。不允许在没有更新申报资料内容的情况下仅对元数据进行更改,也不允许在更新元数据时,仅对其对应部分申报资料的内容进行变更。例如,申请人更新 2.3.S 和 3.2.S 中的活性成分和生产商元数据时,必须删除已有的 2.3.S 和 3.2.S 章节内容,并在新的 2.3.S 和 3.2.S 章节中添加全部相关资料。
更多关于如何合理使用 eCTD 模块二至模块五元数据的指导原则,请参考《ICH eCTD IWG 问题解答和规范变更要求文件 V1.31》。
关于信封元素属性的使用,请参见本文档 4.3 章节。
3.7 扩展节点
扩展节点为申请人提供了自定义目录元素的途径,用以扩展技术规范中既定的 eCTD 目录元素结构,实现将多个叶元素在自定义目录元素下组合显示功能。
扩展节点仅允许在产品类型为生物制品的提交序列的
3.2.R 章节中使用。
3.8 研究标签文件
模块四中的 4.2.X 章节和模块五中的 5.3.1.X-5.3.5.X 章节的所有文件应使用 STF。
非临床试验报告可参考 CTD 模块四相关章节的目录结
构进行组织,并使用“pre-clinical-study-report”标签进行标记。
临床研究报告可参考《ICH E3 临床研究报告的结构和内容》的要求,并使用适当的 STF 文件标签来展现文档的内容。未按照 ICH E3 相关指南编制的临床研究报告可提交单独的 PDF 文件,并使用“legacy-clinical-study-report”标签进行标记。
临床研究报告相关的临床试验数据集应在 eCTD 申报资料中一并提交,在骨架文件中应位于相应的临床研究报告之后,并使用适当的 STF 标签进行标识。更多 eCTD 中临床试验数据集及相关资料的申报要求详见《药物临床试验数据递交指导原则(试行)》。
模块五中的 5.2 所有临床研究列表、5.3.6 上市后报告和5.4 参考文献可以不使用 STF,作为独立的文件提交。更多关于 STF 的信息,请参照《ICH 研究标签文件的 eCTD 骨架文件技术规范 V2.6.1》。
3.9 生命周期操作
在 ICH 技术规范中,针对每个文件都赋予了 4 个生命周期的操作类型:新建、替换、删除和增补。
推荐使用“新建”、“替换”和“删除”操作类型。除对 STF 进行的操作,其他情况下不建议使用“增补”操作类型。
申请人对 STF 以外的文件进行增补操作,将导致申报资料验证时出现警告信息,对此申请人应在说明函中做出解释。对 STF 进行增补操作,验证时不会出现警告信息。
3.10 电子签名
符合《中华人民共和国电子签名法》要求的电子签名与手写签名或者盖章具有同等的法律效力。eCTD 申请中将接受上述电子签名的使用。
3.11 eCTD 提交方式
申请人准备的 eCTD 申报资料需通过物理电子媒介提交。目前只接受一次写入型光盘作为存储介质,包括 CD-R、DVD+R、DVD-R 这三类。不得使用双面DVD或对提交的申报资料设置密码保护。
4. 模块一的总体架构
《ICH eCTD 技术规范 V3.2.2》明确了模块一应包含区域特定的行政文件和药品信息。模块一的内容和编号要求参见《M4:人用药物注册申请通用技术文档》模块一文件。
申请人需要提交的模块一的内容包含有模块一文件夹和文档以及模块一的骨架文件,其输出文件夹基本结构示例如下图9所示:

4.1 创建模块一骨架文件
模块一骨架文件由 XML 根元素、信封元素、目录元素三个部分组成。申请人可按照以下步骤为给定的序列创建模块一的骨架文件:
1. 创建一个标准的 XML 文件及 XML 根元素。
2. 创建符合标准的信封信息,用来描述该序列。
3. 按照《M4:人用药物注册申请通用技术文档》模块一文件的内容,创建该序列所需的目录元素和叶元素。
(1) 目录元素,参照 CTD 模块一的目录结构。
(2) 叶元素,包含序列中提交的单个文件的引用地址、校验和及生命周期操作等信息。
4. 命名模块一的 eCTD 骨架文件为 cn-regional.xml,并将其放置在模块一的cn子文件夹中。
4.2 XML 根元素
所有模块一的骨架文件都应包含标准 XML 根元素。其信息包括 XML 声明以及根元素<cn_ectd>,该根元素的属性将这个 XML 文件链接到指定的 XML 定义文件。如下图10 所示:

4.3 信封元素
信封元素包含的属性信息如下表6所示,各属性详细介绍请参见本文档“申请信息”(2.1 章节)、“注册行为信息”(2.2 章节)、“序列信息”(2.3 章节)。
表6:信封元素
针对申请人提交的每个序列,所有属性均为必填项,并有且仅有一个值。在同一申请中,申请人不允许更新申请级别的信封元素属性信息,即申请编号、申请类型、产品类型和原始编号。在同一注册行为中,申请人不允许更新注册行为级别的信封元素属性信息,即相关序列、注册行为类型。
对于有受控词汇的信封元素属性,在骨架文件中记录的属性值必须为受控词汇文件中定义的代码名称,而信封实际显示信息中只展示对应代码的显示值。
信封元素在骨架文件中的呈现形式如下图 11 所示:

信封元素的实际显示信息如下图 12 所示:

受控词汇文件中的每个代码都有对应的版本号、生效日期、失效日期(可选),用来标识该代码适用的时间范围。申请人在使用代码时应注意其对应版本的开始生效日期和失效日期,并使用有效的代码。
受控词汇文件的详细信息如下图 13 所示:

4.4 目录元素
每个目录元素的内容由一个或多个叶元素组成。
叶元素包含了《ICH eCTD 技术规范 V3.2.2》中定义的<title>元素及一系列属性,如“operation”、“xlink:href”、“checksum-type”、“checksum”等。其中“checksum-type”属性的值必须设置为“MD5”或“md5”。
叶元素的叶标题内容应当简短、明确并能提供有用信息。
目录元素在骨架文件中的内容如下图 14 所示:

目录元素实际显示信息如下图 15 所示:

5. 参考2
2 相关参考文件可参见 ICH 网站( https://www.ich.org/ )、药品审评中心网站( https://www.cde.org.cn/ )
以下文档规范应与本文档一起作为参考,以确保申报资料符合 eCTD 整体的要求。通常情况下,除非本文档中另有说明,否则应遵守以下这些文档规范。此外,除非在《eCTD 实施指南 V1.0》中有特别说明,申请人应遵循所有其它区域性的 CTD 指导文件。
1. ICH eCTD Specification and Related files
——ICH eCTD 技术规范和相关文件,包括变更控制过程、变更请求表和问答文档。
2. ICH Electronic Common Technical Document Specification V3.2.2
——《ICH eCTD 技术规范 V3.2.2》
3. ICH The eCTD Backbone File Specification for Study Tagging Files V2.6.1
——《ICH 研究标签文件的 eCTD 骨架文件技术规范V2.6.1》
4. ICH Specification for Submission Formats for eCTD V1.2
——《ICH eCTD 文件格式规范 V1.2》
5. ICH eCTD IWG Question and Answer and Specification Change Request Document V1.31
——《ICH eCTD IWG 问题解答和规范变更要求文件V1.31》
6. ICH E3 Structure and Content of Clinical Study Reports
——《ICH E3 临床研究报告的结构和内容》
7.《M4 模块一行政文件和药品信息》
8.《药物临床试验数据递交指导原则(试行)》
6. 术语表
